Elektrolyse
Definition: ein elektrochemischer Prozess, bei dem chemische Reaktionen mit Hilfe elektrischer Energie angetrieben werden
Spezifischere Begriffe: Niedertemperaturelektrolyse, Hochtemperaturelektrolyse, alkalische Elektrolyse, Wasserelektrolse, Co-Elektrolyse
Englisch: electrolysis
Kategorien: elektrische Energie, Grundbegriffe
Autor: Dr. Rüdiger Paschotta
Wie man zitiert; zusätzliche Literatur vorschlagen
Ursprüngliche Erstellung: 19.11.2010; letzte Änderung: 16.04.2025
Die Elektrolyse ist ein elektrochemischer Prozess. Hier werden chemische Reaktionen mit Hilfe elektrischer Energie angetrieben. Im Rahmen der Energietechnik dient die Elektrolyse zur Herstellung chemischer Energieträger, und zwar oft von Wasserstoff. Es wird also elektrische Energie in chemische Energie umgewandelt. (Der umgekehrte Prozess läuft ab in aufladbaren Batterien und Brennstoffzellen.) In anderen Fällen geht es um die Herstellung von Substanzen für nicht-energetische Nutzungen, beispielsweise Aluminium, Chlor oder Natronlauge. Ebenfalls wird die Elektrolyse für die Reinigung (Raffinierung) gewisser Metalle eingesetzt.
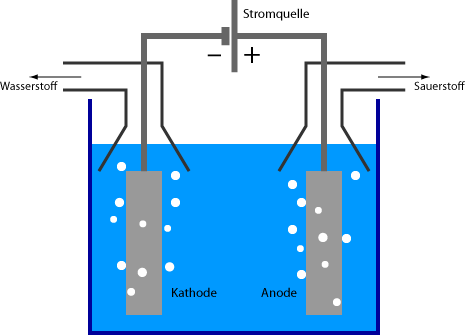
Typischerweise enthält ein Elektrolyseur (Elektrolyseapparat) zwei Elektroden, die mit einer elektrisch leitenden Flüssigkeit (einem Elektrolyten) in Kontakt gebracht werden. Zwischen den Elektroden wird eine elektrische Spannung angelegt, so dass ein elektrischer Strom fließt. Die elektrische Stromstärke bestimmt direkt die pro Sekunde umgesetzten Stoffmengen. Die negative Elektrode wird als Kathode bezeichnet, die positive als Anode. An den Elektroden können neue chemische Substanzen entstehen, und es ist ebenfalls möglich, dass Elektrodenmaterial in die Lösung übergeht. Um dies zu vermeiden, können Elektroden aus bestimmten Edelmetallen gefertigt werden (z. B. aus Gold oder Platin) oder aus Graphit.
Obwohl die Wasserelektrolyse schon seit Jahrzehnten optimiert wurde, braucht man noch immer wertvolle Edelmetalle für die Elektroden. Dies hat einen wesentlichen Einfluss auf die Kosten und erschwert die breite Anwendung der Technologie. Jedoch ist weiterhin Forschung im Gange mit dem Ziel, ohne teure Edelmetalle genügend stabile und gleichzeitig auch energieeffiziente Elektroden (siehe unten) zu erhalten.
Häufig werden der Anoden- und Kathodenraum durch eine poröse Wand (ein Diaphragma, z. B. aus einem Harz bestehend, oder eine spezielle Membran) voneinander getrennt. Damit lässt sich beispielsweise verhindern, dass sich die entstehenden Gase miteinander vermischen. Allerdings behindert eine solche Membran auch mehr oder weniger den Stromfluss und kann auf diese Weise die umgesetzte Leistung reduzieren und/oder eine etwas erhöhte elektrische Spannung notwendig machen, was den Wirkungsgrad herabsetzt.
Bei der Wasser-Elektrolyse für die Herstellung von Wasserstoff und Sauerstoff wird die Leitfähigkeit des Wassers erhöht, indem bestimmte Säuren oder Basen (Laugen) beigegeben werden. (Verbreitet ist die alkalische Wasserelektrolyse nach dem Claude-Prozess.) An der Kathode entsteht Wasserstoff, an der Anode Sauerstoff, der vom Wasserstoff getrennt bleiben muss und ebenfalls genutzt werden kann. Um die Oxidation der Anode zu vermeiden, muss diese beispielsweise aus einem Edelmetall oder aus Nickel gefertigt sein.
Bei kleinen Elektrolyseanlagen im unteren Kilowatt-Bereich sind die spezifischen Anlagenkosten relativ hoch (mehrere tausend Euro pro Kilowatt), während große Anlagen im Megawattbereich für einige hundert €/kW errichtet werden können.
Die Technik von Elektrolyseuren wird seit Jahrzehnten genutzt, vor allem auch großtechnisch, und ist an sich bereits sehr ausgereift. Trotzdem erhofft man sich von weiteren Entwicklungen noch Verbesserungen, insbesondere einen noch höheren Wirkungsgrad und einen geringeren Bedarf an teuren Metallen, damit auch geringere Investitionskosten. Eine besonders hohe Effizienz scheint mit der Kapillarelektrolyse möglich zu sein, die hoffentlich erfolgreich kommerzialisiert werden kann.
Es gibt reversible Zellen, die einerseits zur Elektrolyse eingesetzt werden können, andererseits aber auch umgekehrt als Brennstoffzelle.
Energieeffizienz der Elektrolyse
Die Energieumwandlung bei der Elektrolyse kann recht energieeffizient erfolgen, d. h. mit einem hohen Wirkungsgrad. Hierfür ist es besonders wichtig, dass die elektrische Spannung kaum höher gewählt wird als physikalisch notwendig. Hohe Stromdichten, wie sie eine hohe Produktionsrate verlangt, und die Bildung von Gasen an den Elektroden erzwingen allerdings häufig eine etwas höhere Spannung. Bei der Wasser-Elektrolyse wird typischerweise ein Wirkungsgrad von etwas über 70 % erreicht, teilweise auch mehr als 80 %. Im Teillastbetrieb kann der Wirkungsgrad deutlich höher liegen. Von neuen Entwicklungen erhofft man, Wirkungsgraden von weit über 90 % zu erzielen.
Verschiedene Arten von Wirkungsgrad-Angaben können einzelne der genannten Aspekte erfassen:
- Der Stromwirkungsgrad (oder Faraday-Wirkungsgrad) ($\epsilon_I$) erfasst allein den Aspekt, ob elektrische Ladung teilweise verloren geht. Idealerweise braucht man zwei Elektronen pro H2-Molekül, entsprechend 192704 C pro Mol (2 g H2) oder 96352 C pro Gramm.
- Der Spannungswirkungsgrad ($\epsilon_V$) berücksichtigt nur die nötige Zellspannung im Vergleich zum theoretischen Idealwert (thermoneutrale Spannung, 1,48 V bei Standardbedingungen).
- Der Zellwirkungsgrad ist der energetische Wirkungsgrad einer Elektrolysezelle. Er ergibt sich als das Produkt von Stromwirkungsgrad und Spannungswirkungsgrad.
Wichtig ist die Bemerkung, dass der berechnete Wirkungsgrad davon abhängt, wie man den Energiegehalt des Wasserstoffs bewertet: mit dem Brennwert oder dem (deutlich niedrigeren) Heizwert. Bezogen auf den Brennwert kommt man auf entsprechend höhere Werte. Sinnvoll kann die eine oder andere Variante sein, je nachdem ob der erzeugte Wasserstoff später durch Verbrennung ohne Gewinnung der Kondensationswärme genutzt werden soll (etwa in einem Verbrennungsmotor) oder nicht. Leider wird häufig nicht erwähnt, auf welchen Wert man sich mit dem Wirkungsgrad der Elektrolyse bezieht. Meistens dürfte es der höhere Wert basierend auf dem Brennwert sein.
Wenn ein Elektrolyseur nur für die Verwendung von Stromüberschüssen verwendet würde, also mit relativ wenigen Volllaststunden pro Jahr, dann würde er normalerweise vorwiegend für möglichst niedrige Anlagekosten optimiert. Das führt tendenziell zu einer niedrigeren Energieeffizienz, z. B. nur ca. 60 bis 65 % Wirkungsgrad.
Wenn Wasserstoff-Elektrolyse als Speicher für elektrische Energie verwendet werden soll, fallen natürlich auch die Energieverluste bei der Verstromung des Wasserstoffs ins Gewicht; der Zyklenwirkungsgrad liegt dann je nach Technologie eher bei 40 % oder sogar tiefer.
Weitere Forschung und Entwicklung könnte zu verbesserten Elektrolyse-Technologien führen, die vor allem auch einen höheren Wirkungsgrad ermöglichen würden. Interessant sind beispielsweise Ansätze für die Hochtemperaturelektrolyse (Dampfelektrolyse, z. B. in Festoxid-Elektrolysezellen bei 800 bis 1000 °C), bei der ein Teil der benötigten Energie in Form von Hochtemperaturwärme anstatt von Strom zugeführt werden kann. Dies lässt sich so verstehen, dass zunächst die Verdampfung des Wassers allein mit Wärmezufuhr geschehen kann und somit entsprechend weniger elektrische Energie benötigt wird. Hochtemperatur-Elektrolyseure lassen sich auch ohne teurere Edelmetalle realisieren. Solche Verfahren befinden sich aber noch in einem frühen Entwicklungsstadium. Sie wären besonders interessant in Verbindung mit solarthermischen Kraftwerken.
Eine mögliche Quelle der benötigten Hochtemperaturwärme wäre eine Anlage zur Methanisierung, d. h. zur Gewinnung von Methan aus dem erzeugten Wasserstoff.
Auch die Kapillarelektrolyse scheint ein interessanter, potenziell sehr effizienter Ansatz zu sein. Sie muss aber ebenfalls erst noch erfolgreich kommerzialisiert werden.
Manche Elektrolyseure können bei hohem Druck arbeiten, d. h. Wasserstoff bereits komprimiert z. B. auf 10 bar bereitstellen, während andere nur bei Normaldruck funktionieren, so dass ggf. eine zusätzliche Kompression nötig ist (mit weiterem Energieaufwand). Dieser Aspekt muss also bei der Beurteilung der Effizienz auch berücksichtigt werden.
Rolle der Elektrolyse in der Energietechnik
Bisher spielt die Elektrolyse keine wichtige Rolle in der Energietechnik. Sie könnte in Zukunft im Rahmen einer Wasserstoffwirtschaft an Bedeutung gewinnen. Hier würde Wasserstoff aus elektrischer Energie mittels Elektrolyse gewonnen, und umgekehrt könnte aus Wasserstoff mit Hilfe von Brennstoffzellen auch wieder elektrische Energie erzeugt werden. Große Energiemengen ließen sich z. B. mit Hilfe von Wasserstoff-Pipelines relativ verlustarm über weite Strecken transportieren. Ebenfalls würde Wasserstoff eine Energiespeicherung auch über längere Zeiten ermöglichen, was beispielsweise im Zusammenhang mit der Nutzung von stochastisch anfallender erneuerbaren Energien wie Windenergie und Solarenergie interessant wäre. Jedoch treten beträchtliche Energieverluste bei den Umwandlungen auf – bisher mindestens ca. 50 % bei der Umwandlung von Strom zu Wasserstoff und zurück. Zudem ist die Speicherung des Wasserstoffs aufwendig.
Eine andere Variante ist Power to Gas mit einer zusätzlichen Methanisierung: Wenn aus dem Wasserstoff Methan gewonnen wird, kann dieses in das Erdgasnetz eingespeist werden. Somit werden bereits existierende Erdgasnetze und Erdgasspeicher nutzbar als eine sehr leistungsfähige Transport- und Speicherinfrastruktur.
Mancherorts ist es ökonomisch sinnvoll, benötigte relativ kleine Mengen von Wasserstoff (z. B. für Gabelstapler) mithilfe von Elektrolyse aus Solarstrom dezentral zu erzeugen, da in kleinen Mengen in Flaschen gelieferter Wasserstoff relativ teuer ist. Die dezentrale Speicherung von Wasserstoff zum Zwecke der späteren Verstromung in einer Brennstoffzelle wäre dagegen in der Regel kaum wirtschaftlich realisierbar.
In manchen Fällen ist der zusätzlich anfallende Sauerstoff auch gut nutzbar – beispielsweise bei Kläranlagen für Belebungsbecken. Meistens wird der Sauerstoff aber nutzlos in die Luft abgegeben.
Die Verwendung von Solarstrom für die Elektrolyse wird besonders interessant für alte Anlagen, die bereits keine EEG-Förderung für eingespeisten Strom mehr erhalten.
Nicht-energetische Anwendungen von Elektrolyse (hauptsächlich in der Metallurgie und der chemischen Industrie) sind heute schon bedeutsam. Hierfür werden in den USA rund 5 % der gesamten Stromerzeugung benötigt – in Europa deutlich weniger, weil Wasserstoff hauptsächlich aus Erdgas gewonnen wird.
Elektrolyse mit Meerwasser
Es gibt Überlegungen, Elektrolyse im großen Stil in Anlagen im Meer zu betreiben, wobei die Betriebsenergie entweder von schwimmenden Photovoltaikanlagen oder von Windenergieanlagen erzeugt wird. Hier müsste dann Meerwasser verwendet werden. Dieses ist leider in der Regel nicht direkt für die Elektrolyse anwendbar, weil der Chlorid-Gehalt zu unerwünschten Bildung von Chlor führt (mit diversen Nebenwirkungen) und weil Calcium-Verbindungen Belege auf den Elektroden bilden können, die die Energieeffizienz reduzieren. Deswegen müsste hier zunächst eine Meerwasserentsalzung vorgenommen werden, z. B. mit Umkehrosmose. Dies würde einen gewissen zusätzlichen Strombedarf verursachen, der allerdings im Vergleich zu dem der Elektrolyse fast vernachlässigbar gering ist. Insofern stünde einer Nutzung von Meerwasser für die Elektrolyse kein entscheidendes Hindernis entgegen.
Co-Elektrolyse
Ein Sonderfall der Elektrolyse ist die sogenannte Co-Elektrolyse. Hier werden zwei oder mehr verschiedene Elektrolyseprozesse gleichzeitig in einem Apparat durchgeführt. Insbesondere ist in den letzten Jahren die Entwicklung eines Elektrolysesprozesses in Hochtemperatur-Feststoffzellen erfolgt, bei dem gleichzeitig Wasserstoff aus Wasser erzeugt wird sowie Kohlenmonoxid aus Kohlendioxid. Somit lässt sich direkt Synthesegas erzeugen, und zwar nicht nur mit einer einfacheren Apparatur, sondern auch mit einer deutlich höheren Energieeffizienz. Solche Entwicklungen könnten zukünftig eine effizientere und kostengünstigere großtechnische Erzeugung von strombasierten Synthesekraftstoffen ermöglichen.
Siehe auch: elektrische Energie, chemische Energie, chemische Energiespeicherung, Wasserstoff, Wasserstoffwirtschaft, EE-Gas, Power to Gas, Power to X

Wenn Ihnen diese Website gefällt, teilen Sie das doch auch Ihren Freunden und Kollegen mit – z. B. über Social Media durch einen Klick hier:
Diese Sharing-Buttons sind datenschutzfreundlich eingerichtet!