Latente Wärme
Definition: Wärme, die von einem Gegenstand aufgenommen oder abgegeben wird, ohne dass sich dabei seine Temperatur ändert
Allgemeiner Begriff: Wärme
Gegenbegriff: fühlbare Wärme
Englisch: latent heat
Kategorien: Energiespeicherung, physikalische Grundlagen, Wärme und Kälte
Autor: Dr. Rüdiger Paschotta
Wie man zitiert; zusätzliche Literatur vorschlagen
Ursprüngliche Erstellung: 09.03.2010; letzte Änderung: 04.05.2025
Latente Wärme ist Wärme, die von einem Gegenstand aufgenommen oder abgegeben wird, ohne dass sich dabei seine Temperatur ändert. Diese Situation tritt auf, wenn Wärme bei Phasenübergängen verbraucht oder freigesetzt wird.
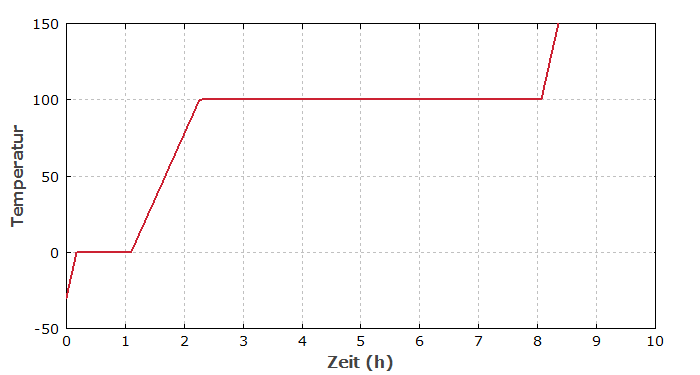
Abbildung 1 zeigt den zeitlichen Verlauf der Temperatur, wenn 1 kg Wassereis (anfänglich bei −30 °C) mit einer Leistung von 100 W gleichmäßig aufgeheizt wird. Die stetige Wärmezufuhr führt zunächst zu einem stetigen Temperaturanstieg bis 0 °C. Danach bleibt die Temperatur für einige Zeit bei 0 °C; die zugeführte Wärme wird vollständig für das Schmelzen des Eises aufgebraucht (als Schmelzwärme), anstatt zu einer Temperaturerhöhung zu führen. Insofern bleibt die Wärmezufuhr verborgen (latent), obwohl die Enthalpie ständig wächst. Erst wenn alles Eis geschmolzen wird, steigt die Temperatur des Wassers weiter an. Bei 100 °C beginnt das Wasser zu verdampfen; erst wenn die Verdampfungswärme für das ganze Wasser aufgebracht wurde, kann die Temperatur des Dampfes weiter ansteigen. Da die Verdampfungswärme wesentlich größer als die Schmelzwärme ist, dauert das Verdampfen entsprechend länger.
Umgekehrt sind die Verhältnisse beim stetigen Wärmeentzug, z. B. beginnend mit flüssigem Wasser. Sobald das Einfrieren (Erstarren) beginnt, bleibt die Temperatur bei 0 °C, bis alles Wasser gefroren ist. Die gesamte Schmelzwärme wird als Erstarrungswärme wieder frei und verhindert in dieser Zeit den Temperaturabfall. Auf ähnliche Weise wird beim Kondensieren von Wasserdampf die Kondensationswärme wieder frei.
Es gibt auch andere Phasenwechselmaterialien (PCM = phase change materials), die latente Wärme speichern können. Beispielsweise haben gewisse Wachse (Paraffine) Phasenwechseltemperaturen nahe der Zimmertemperatur und sind somit gut geeignet, um das Wärmespeichervermögen von Baumaterialien stark zu erhöhen. Für etwas höhere Phasenwechseltemperaturen sind gewisse Salzhydrate geeignet, beispielsweise Glaubersalz und Natriumacetat. Letzteres kann durch Wärmezufuhr bei 58 °C verflüssigt werden, wobei es sich nicht um ein Schmelzen handelt, sondern um das Auflösen des Salzes im eigenen Kristallwasser. Beim späteren Kristallisieren wird die gespeicherte Wärme wieder frei. Eine Besonderheit ist, dass die Kristallisation nicht zwangsläufig bei Unterschreiten von 58 °C auftritt, sondern bei Fehlen von Kristallisationskeimen selbst bei Frosttemperaturen noch unterbleiben kann. Wird die Kristallisation z. B. durch Einbringen eines Keims ausgelöst, steigt die Temperatur rapide auf 58 °C an. Dieser Effekt wird z. B. in aufladbaren Wärmekissen ausgenützt.
Latente Wärme in der Energietechnik
In der Energietechnik ist das Phänomen der latenten Wärme verschiedentlich relevant:
- Die Verdampfungs- und Kondensationswärme spielt eine wichtige Rolle bei der Funktion von Dampfturbinen.
- In Brennwertkesseln wird die Kondensationswärme mit genutzt, die gesamte Wärmeausbeute also entsprechend erhöht.
- Luft mit hoher Luftfeuchtigkeit hat eine höhere Enthalpie (pro Kubikmeter) als gleich warme trockene Luft. Die Verdampfung von Wasser benötigt nämlich Wärme, die dann als latente Wärme in der Luft steckt.
- Die Wärmespeicherfähigkeit eines Hauses kann erhöht werden, indem Latentwärmespeicher eingebaut werden. Diese enthalten Phasenwechselmaterialien, z. B. Salze oder kleine Wachskügelchen, die bei einer gewissen Temperatur schmelzen und dabei Wärme aufnehmen, die sie beim Erstarren wieder abgeben (siehe oben).
- Es sind auch mobile Wärmespeicher entwickelt worden, bei denen ein latenter Wärmespeicher (z. B. auf der Basis von Natriumacetat) mit Abwärme z. B. von einem Kraftwerk aufgeladen wird, mit einem Lkw zu einem Verbraucher gefahren und dort entladen wird. Dies kann wirtschaftlich sein, wenn die Transportdistanz genügend gering, aber eine Nahwärmeleitung doch zu teuer wäre.
- Kleine Latentwärmespeicher werden vereinzelt in Autos verwendet, um den Motorblock vor dem Start vorzuwärmen. Während der Fahrt werden sie vom Kühlwasser des Motors wieder aufgeheizt.
Kleine Wärmekissen auf der Basis von Natriumacetat werden verwendet, um an eisigen Wintertagen die Hände zu wärmen. Andere Anwendungen gibt es in speziellen Funktionstextilien, bereits auch in Waschmaschinen und Geschirrspülmaschinen zur Rückgewinnung von Wärme aus dem Abwasser.
Siehe auch: Latentwärmespeicher, Wärme, Brennwertkessel, Temperatur, Enthalpie, Verdampfungswärme und Kondensationswärme, Schmelzwärme und Erstarrungswärme

Wenn Ihnen diese Website gefällt, teilen Sie das doch auch Ihren Freunden und Kollegen mit – z. B. über Social Media durch einen Klick hier:
Diese Sharing-Buttons sind datenschutzfreundlich eingerichtet!