Lachgas
Definition: ein klimaschädliches Stickoxid mit der chemischen Formel N2O
Alternativer Begriff: Distickstoffmonoxid
Allgemeiner Begriff: Treibhausgas
Englisch: laughing gas, nitrous oxide
Kategorie: Ökologie und Umwelttechnik
Autor: Dr. Rüdiger Paschotta
Wie man zitiert; zusätzliche Literatur vorschlagen
Ursprüngliche Erstellung: 24.01.2020; letzte Änderung: 04.05.2025
Lachgas ist der Trivialname von Distickstoffmonoxid (chemische Formel: N2O). Diese Substanz gehört zu den Stickoxiden.
Physikalisch-chemische Eigenschaften
Lachgas hat bei Normaldruck einen Siedepunkt von −88.5 °C. Bei Zimmertemperatur lässt es sich unter hohem Druck (ca. 5 MPa = 50 Atmosphären) verflüssigen.
Die Bildung von Lachgas aus Sauerstoff und Stickstoff ist endotherm, d. h. sie benötigt die Zufuhr von Energie. Der exotherme (Wärme freisetzende) Zerfall von Lachgas in Sauerstoff und Stickstoff findet nur bei hohen Temperaturen ab ca. 600 °C mit erheblicher Geschwindigkeit statt.
Lachgas wirkt oxidierend und deswegen in hohen Konzentrationen stark brandfördernd. Darauf beruht sein Nachweis mit einer Glimmspanprobe: ein glimmender Holzspan flammt bei Kontakt mit Lachgas deutlich auf.
Vor allem in kaltem Wasser ist Lachgas gut löslich.
Wirkung auf den menschlichen Körper
Lachgas hat einen schwach süßlichen Geruch. Seine Bezeichnung beruht auf der bereits im 18. Jahrhundert festgestellten psychoaktiven Wirkung. Es wirkt auch betäubend und schmerzstillend und wird deswegen bis heute häufig als leichtes Betäubungsmittel z. B. bei zahnärztlichen Operationen verwendet. Allerdings ist sein Einsatz in der Medizin rückläufig, auch wegen der Klimaschädlichkeit (siehe unten). Dagegen nimmt sein Missbrauch als Partydroge anscheinend zu. Obwohl die direkte Giftigkeit von Lachgas gering ist, kommt es vor allem durch Sauerstoffmangel bei Missbrauch gelegentlich zu schweren Unfällen, auch zu Todesfällen.
In niedrigen Konzentrationen wirkt Lachgas kaum auf den menschlichen Körper und ist deswegen beispielsweise als Treibgas in Schlagsahne-Dosen zugelassen.
Klimaschädlichkeit von Lachgas
Durch natürliche Quellen von Lachgas (siehe unten) enthielt die Erdatmosphäre immer schon eine gewisse Lachgas-Konzentration – in den letzten Jahrhunderten bei ca. 270 ppb. Lachgas war also immer ein natürliches Spurengas. Seit ca. 1900 ist seine Konzentration in der Atmosphäre durch menschliche Aktivitäten – insbesondere durch Änderungen der Landnutzung – deutlich angestiegen auf derzeit schon über 330 ppb, mit immer noch stark steigender Tendenz (siehe Abbildung 1).
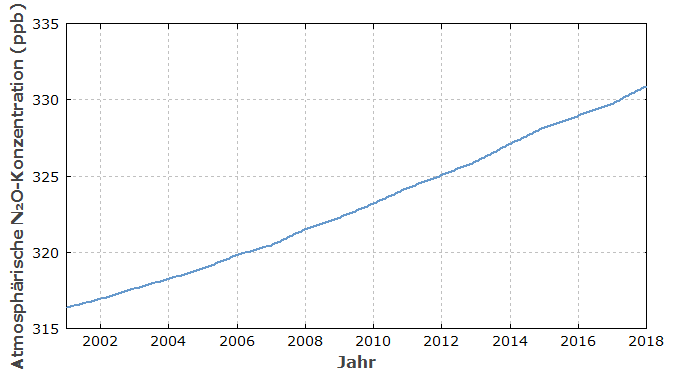
Solche Konzentrationen haben wohl keinen direkten Einfluss auf Lebewesen, tragen aber wesentlich zum Treibhauseffekt bei: Lachgas-Moleküle absorbieren infrarotes Licht (Wärmestrahlung) und reduzieren deswegen die Abstrahlung der Erde in den Weltraum mehr als den Einfall von Sonnenstrahlung. Daraus ergibt sich ein wesentlicher Beitrag zur Klimaerwärmung.
Unter den durch menschliche Aktivitäten erzeugten bzw. vermehrten Treibhausgasen hat Lachgas von seiner Klimawirkung her die dritte Position – nach Kohlendioxid und Methan. Diese Emissionen entsprechen einigen Milliarden Tonnen CO2-Äquivalenten und machen rund ein Zehntel des Beitrags zur Klimaerwärmung aus. Deswegen erfordert der Klimaschutz die Minimierung von Lachgas-Emissionen – wobei die Emissionen durch die Landwirtschaft im Vordergrund stehen, da sie den größten Teil ausmachen.
Der Einwand, die Lachgas-Konzentration habe sich relativ gesehen ja nicht massiv erhöht und sei deswegen irrelevant, ist falsch. Bekanntlich ist bereits der natürliche Treibhauseffekt sehr stark, sodass schon eine relativ geringfügige Verstärkung desselben eine erhebliche Klimaerwärmung bewirkt.
Abbau von Lachgas; Schädigung der Ozonschicht
In der Stratosphäre wird Lachgas bei photochemischen Prozessen sehr langsam wieder abgebaut. Die resultierende Verweilzeit in der Atmosphäre liegt bei etwa 120 Jahren. Klimaschädliche Wirkungen bleiben also für lange Zeit erhalten.
Beim Abbau von Lachgas entsteht Stickstoff und Sauerstoff, zum Teil aber auch Stickstoffmonoxid (NO). Dieses trägt leider zum Abbau der Ozonschicht bei, die die Erde vor ultraviolettem Licht der Sonne schützt. Aufgrund der wirksamen Reduktion der Emissionen von Fluorchlorkohlenwasserstoffen (FCKW) ist der Beitrag des Lachgases zu diesem Problem heute dominierend.
Quellen von Lachgas
Biologische Quellen
Lachgas entsteht in großem Umfang bei biologischen Prozessen, beispielsweise im Boden durch Bakterien, die Stickstoffverbindungen verwerten. Gleichzeitig kann Lachgas im Boden auch wieder abgebaut werden. Je nach den Verhältnissen kann jedoch einiges vom gebildeten Lachgas in die Atmosphäre entweichen. Besonders hohe Mengen von Lachgas entstehen in landwirtschaftlichen Böden, die stark mit Stickstoffdüngern (synthetische Dünger oder auch Gülle) versehen werden. (Durch Reduktion der Stickstoffdüngung, aber auch durch Ausbringung von Pflanzenkohle lassen sich solche Emissionen vermindern.) Besonders problematisch ist intensive Viehhaltung, da diese den zusätzlichen Anbau von Futterpflanzen voraussetzt. In deutlich geringerem Maß entsteht Lachgas bei ökologischem Landbau und auf nicht menschlich genutzten Flächen.
Problematisch ist auch die zusätzliche Emission von Lachgas beim Anbau von Energiepflanzen, z. B. zur Gewinnung von Biodiesel oder Bioethanol. Unter anderem durch die Klimaschädlichkeit des Lachgases werden erhoffte Klimaschutzbeiträge solcher Biokraftstoffe oft ins Gegenteil verkehrt, d. h. die klimaschädliche Wirkung ist insgesamt sogar größer als bei Erdöl-basierten Kraftstoffen.
Verbrennungsprozesse
Lachgas kann wie andere Stickoxide bei Verbrennungsprozessen entstehen, z. B. bei der Verbrennung von Biomasse. Allerdings sind die Voraussetzungen für seine Entstehung deutlich anders als bei anderen Stickoxiden. Hohe Verbrennungstemperaturen, die generell die Bildung von Stickoxiden fördern, führen zu einem schnellen Zerfall des Lachgases. Dagegen können beispielsweise die Verhältnisse in einer Wirbelschichtfeuerung, wie sie in manchen Kohlekraftwerken eingesetzt wird, zu relativ hohen Lachgas-Emissionen führen, während andere Stickoxide relativ wenig produziert werden.
Auch Drei-Wege-Katalysatoren, die heute in sehr vielen Fahrzeugen mit Ottomotor eingesetzt werden, sowie SCR-Katalysatoren bei Fahrzeugen mit Dieselmotor können ungewollt zu Emissionen von Lachgas führen.
Technische Nutzung
Lachgas wird auf verschiedene Weisen, aber nicht in sehr großem Umfang technisch genutzt. Bereits oben erwähnt wurde seine Verwendung als Treibgas für Schlagsahne-Dosen.
In manchen Raketenantrieben wird Lachgas als Oxidationsmittel verwendet. Durch seine physikalischen Eigenschaften (mit Führung in flüssigem Zustand, leichtes Verdampfen) ist es für diese Anwendung besonders praktisch. Es bleibt zu hoffen, dass das Lachgas im Raketenantrieb möglichst vollständig abgebaut wird.
Eher exotisch ist die Zugabe von Lachgas zur kurzfristigen Leistungssteigerung von Ottomotoren.
In geringen Mengen wird Lachgas bei diversen wissenschaftlichen Anwendungen eingesetzt.
Siehe auch: Stickoxide, Treibhauseffekt, CO2-Äquivalente

Wenn Ihnen diese Website gefällt, teilen Sie das doch auch Ihren Freunden und Kollegen mit – z. B. über Social Media durch einen Klick hier:
Diese Sharing-Buttons sind datenschutzfreundlich eingerichtet!